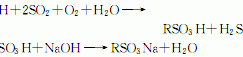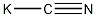
结构式
| 物竞编号 | 03YR |
|---|---|
| 分子式 | KCN |
| 分子量 | 65.12 |
| 标签 |
山奶钾, Potassium cyanide solution, 掩蔽剂, 配合剂, 杀虫剂, 照相定影剂, 印刷线路板电镀用原材料 |
编号系统
CAS号:151-50-8
MDL号:MFCD00011397
EINECS号:205-792-3
RTECS号:TS8750000
BRN号:3593645
PubChem号:24881807
物性数据
1.性状:白色结晶或粉末,易潮解。[12]
2.pH值:11(0.1mol/L水溶液)[13]
3.熔点(℃):634.5[14]
4.相对密度(水=1):1.52[15]
5.辛醇/水分配系数:-1.69[16]
6.溶解性:易溶于水、乙醇、甘油,微溶于甲醇、氢氧化钠水溶液。[17]
毒理学数据
1.急性毒性[18] LD50:5mg/kg(大鼠经口)
2.刺激性 暂无资料
3.致突变性[19] DNA抑制:小鼠淋巴细胞1mmol/L。细胞遗传学分析:人淋巴细胞70mg/L(24h)。DNA损伤:大鼠肝300μmol/L。
生态学数据
1.生态毒性 暂无资料
2.生物降解性 暂无资料
3.非生物降解性 暂无资料
4.其他有害作用[20] 该物质对环境有危害,应特别注意对水体的污染。
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率(10-24cm3):无可用的
7、单一同位素质量:64.966781 Da
8、标称质量:65 Da
9、平均质量:65.1157 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积23.8
7.重原子数量:3
8.表面电荷:0
9.复杂度:12.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
性质与稳定性
1.在空气中吸收水分和二氧化碳,逐渐分解并放出有苦杏仁气味的氰化氢。在水中溶解后即水解。水溶液在常温下分解较慢,但在高温、光照射以及有氧化剂存在下即氧化。赤热时,与二氧化碳反应,形成一氧化碳及氰酸钾。与镁、铝等金属反应,形成氮化物。水溶液可溶解多种金属而成络合物。熔融物可腐蚀玻璃及石英。剧毒!
2.溶于2份冷水、一份沸水、100份乙醇、25份甲醇。其水溶液呈碱性,并很快分解。在空气中或吸湿逐渐分解。不能燃烧。受高热或与酸接触会产生剧毒的氰化物气体。与硝酸盐、亚硝酸盐、氯酸盐反应剧烈,有发生爆炸的危险。
3.具有极强的毒性,吸入、吞食或者皮肤接触渗透均会致死;暴露在空气中会导致人恶心、晕眩、头疼和气喘,操作时要十分小心,应该在通风橱中进行。使用该试剂时应小心,不要碰到水,因为它接触水后分解生成HCN毒性气体。该试剂跟氯酸盐、硝酸盐、三氯化氮和氨水混合会形成爆炸性的混合物。
4.稳定性[21] 稳定
5.禁配物[22] 强氧化剂、酸类
6.避免接触的条件[23] 潮湿空气
7.聚合危害[24] 不聚合
贮存方法
储存注意事项[25] 储存于阴凉、干燥、通风良好的专用库房内。实行“双人收发、双人保管”制度。远离火种、热源。包装必须密封,切勿受潮。应与氧化剂、酸类、食用化学品分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.吸收法 将氰化钠与反应生成的氢氰酸气体用一定浓度的氢氧化钾溶液吸收生成氰化钾,然后将溶液送至蒸发器,在50~60℃进行真空蒸发,至过饱和状态,然后在结晶器中结晶,经离心分离,可得含量在92%左右的氰化钾,再在200℃左右进一步干燥脱水,制得氰化钾成品。分离后的母液返回中和反应器。其反应方程式如下:
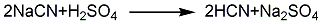

2.将纯HCN气通入纯KOH的乙醇溶液,有KCN沉淀析出。过滤,用乙醇洗涤。在干燥器中减压干燥。
3.将工业品氰化钾溶解于水中,为除去碳酸钾杂质,加入糊状氢氧化钙(氧化钙用水搅和而成),快速搅拌后,静置,过滤。在完全透明滤液中加入适量硫化氢溶液,除去重金属,搅拌、静置后,过滤。滤液于40~60℃下真空蒸发至浆状,停止蒸发,冷却结晶,结晶经抽滤后,于200℃左右干燥即可。
用途
1.用于从矿石提取金和银、金属电镀、钢的热处理、杀虫剂、熏蒸剂、印染助剂、医药、照像、制氰化氢、造纸等。
2.用于矿石浮选提取金和银、电镀、钢的热处理。也用于分析化学试剂和有机腈类产品制造以及制药等。还用于照相、生产丙烯腈和有机玻璃、蚀刻及石印,以及用作柠檬除霉剂等。
3.用作分析试剂、掩蔽剂、杀虫剂及照相定影剂。
4.分析试剂,测定铜、镍、锌、镉等。用作掩蔽体、照相定影剂、杀虫剂及用于提炼金、银等贵重金属等。
5.在氰化镀银中氰化钾是主络合剂,氰化钾和银生成银氰化钾络盐外,在镀液中还要维持一定量的游离氰化钾。其主要作用:能稳定电解液,提高阴极极化,使镀层细致均匀,促进阳极溶解,提高镀液导电能力,在光亮镀银镀液中高浓度氰化钾能发挥光亮剂的大效能。
6.碳链延长反应 氰化钾(KCN)是化学实验室常用的一种试剂,其主要作用在于参与碳链的延长反应,使反应物增加一个碳原子,这在有机合成中有着非常重要的作用。在一定条件下,由卤化烃与氰化钾反应生成腈,使碳链延长[1,2],KCN广泛用于此类碳链延长反应中。在与醇 (式1)[3]、酯、卤化物或醛 (式2)[4] 等反应中,能提供氰基使碳链延长;在这类反应中可以认为反应物与氰化钾发生了加成反应,通过加成可以合成一些复杂化合物[5,6]。
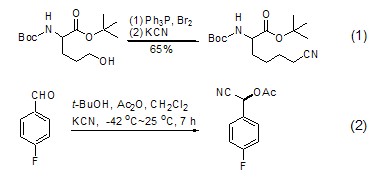
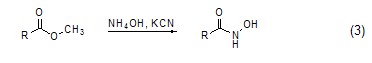
有时候氰化钾参与反应,但是产物的碳链不一定延长。如在氰化钾存在下,氨水可以与羧酸酯反应生成异羟肟酸 (式3)[7]。
作为催化剂 氰化钾除了可以作为反应物外,还可以作为催化剂,如它可以催化某些反应形成C-C键 (式4)[8]。

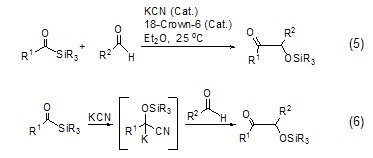
氰化钾与18-冠醚-6组成一个催化系统,具有很强的催化作用,可以用于碳-碳键的偶合反应 (式5)[9],反应机理如式6所示。
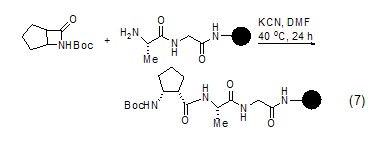
利用氰化钾作为催化剂也可以用于酰胺键的形成,从而使肽链延长(式7)[10]。
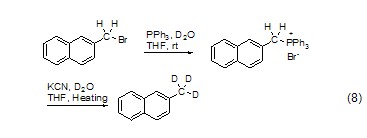
卤代烃与PPh3反应生成盐,在KCN和重水存在下水解,可以得到高产率的氘代产物(式8)[11]。
7.用于提炼金、银等贵重金属和淬火、电镀,及制分析试剂、有机腈类、医药、杀虫剂等。[26]